지트리비앤티 : G-TreeBNT (115450)
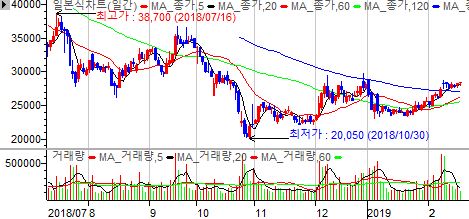
[ 1 ] 실적 분석
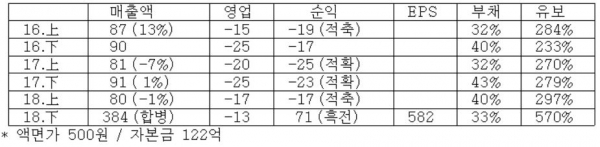
< 분석 결과 > * 투자의견 : 긍정적 대응
NRDO (No Research Development Only) 전략은 중소신약개발사로서 효율적인 방법이며, ReGenTree사를 미국에 만들고, 미국 보건복지부 산하기관에서 30년 동안 근무한 힌다 박사가 개발과정을 총지휘하는 등 신약개발의 지름길을 가고 있다.
가장 상업화가 임박한 RGN-259(안구건조증 치료 물질)에 대해 FDA가 임상 3상의 마지막 단계를 진행중이라 2019년은 신약 탄생의 아주 중요한 시기가 될 듯하다.
RGN-239와 OKN-007은 미국 FDA로부터 희귀의약품으로 지정받았고, 모두 Open Study 중이라 임상 3상 진입(RGN-239)이나 기술이전 계약 가능성 등의 단계에 와있어 언제든 호재가 터질 수 있는 상황이다.
바이오테마시 선도할 수 있는 종목이라 분석되며, 기관 매수 유입시 편승하는 매매전략이 좋겠다.
[ 2 ] 기업 핵심 분석
( 1 ) 양원석 대표와 NRDO (No Research Development Only) 사업 모델
양원석 대표는 NRDO (No Research Development Only) 전략을 추구하고 있다. 즉, 임상 초기단계에서 유망한 신약후보물질을 기술이전(License-in) 받아 3상까지 진행한 뒤 다국적 제약사에 License-out하는 사업전략이다.
양원석 대표는 차바이오앤디오스텍 대표 출신으로, 지트리비앤티가 주력사업을 소프트웨어솔루션에서 바이오제약으로 바꾸기로 하면서 2014년 3월에 영입됐다.
자회사를 설립해 안과 및 희귀질환 치료제를 개발 중이다.
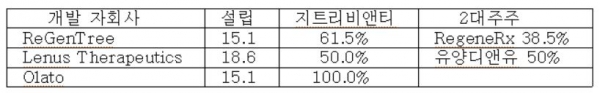
( 2 ) 신약물질 싸이모센 베타4 (Thymosin beta4 : Tß4)와 파이프라인
Tß4(Thymosin beta4)는 43개의 아미노산으로 구성된 펩타이드 성분으로, 세포이동 촉진, 줄기세포의 생성 및 분화, 조직 재생 등을 통해 염증, 세포독성 등을 억제하는 역할을 한다. 조직 복구 및 재생효과는 여러 적응증 치료에 활용이 가능해 획기적 신약으로 탄생할 수 있으며, 부작용과 이상반응이 거의 없다는 점은 신약으로서의 가치를 높이는 요인이다. 지트리비앤티는 Tß4로 안구건조증 치료제 및 수포성 표피박리증 치료제 등을 개발 중이다.
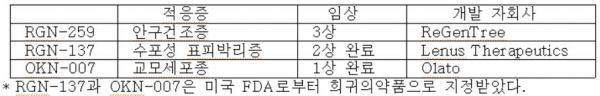
( 3 ) RGN-259 : 안구건조증(Dry-Eye Syndrome) 치료제
안구건조증(Dry Eye Syndrome, DES)은 눈물 결핍이나 과도한 눈물 증발로 인한 눈물막의 장애로 안구 표면의 손상을 가져와 이에 따른 여러 증상이 발생하는 질병이다.
① RGN-259 및 경쟁제품
RGN-259의 성분인 Thymosin Beta4는 신체 내 존재하는 펩타이드로, 안구 표면 조직 손상이나 눈물막 항상성 손상이 원인인 환자까지 포괄적으로 커버할 수 있을 것으로 기대된다. 현재의 안구건조증 치료제인 Restasis와 Xiidra는 모두 항염증제다.
② 개발 현황
Sign과 Symptom 모두 2주차(15일) 데이터를 Primary Endpoint로 하는 ARISE-3(3번째 3상) 프로토콜을 제출하였으며, 최근 FDA로부터 승인을 받았다. 2016년 FDA의 승인을 받은 Shire사의 Xiidra 역시 3차례의 임상 3상을 통해 허가를 받은 바 있다. 지트리비앤티 역시 2019년에 3번째 3상인 ARISE-3를 진행 중이다.
③ 시장 현황
스마트폰 등 모바일기기 사용이 늘면서 안구건조증 환자도 급증 추세다. 세계 안구건조증 치료제 시장은 2014년 21.5억달러에서 2024년에는 45.9억달러로 연평균 8% 성장이 전망된다.
( 4 ) RGN-137 : 수포성 표피박리증 (EB : Epidermolysis Bullosa) 치료제
① 수포성 표피박리증(EB) : 표피와 표피/진피 경계부 등을 구성하는 단백질을 생성하는 유전자 변이에 의해 가벼운 외상에도 쉽게 물집이 발생되어 피부와 점막에 통증이 생기는 희귀 유전성 질환이다.
중증EB환자 대부분은 10세 이전에 사망하는데 반해 치료제가 없는 상황이다.
최근 경쟁 파이프라인이었던 미국 Amicus사의 SD-101이 임상 3상단계에서 약물 개발을 중단하겠다고 밝히면서 사실상 지트리비앤티의 RGN-137 밖에 없다. Amicus는 2015년에, Scioderm사를 8.47억달러에 인수하면서 SD-101을 확보했었다.
② 미국 FDA 가이드라인 변경 및 개발 현황
EB는 완치가 어려운 질병임에도 FDA의 기존 가이드라인은 완치(Complete healing)를 Endpoint로 요구했다. 그러나 새로운 가이드라인은 부분치료(Partial healing)로도 Endpoint 설정이 가능한 것으로 보이며, 또한 FDA는 개발사가 이에 관해 제안하는 것을 권장한다고 했다
이에 지트리비앤티는 새로운 가이드라인에 맞추어 총 15명 환자 대상으로 Open Study 를 진행하고 있다. Open Study이므로 중간결과를 바로 확인할 수 있기 때문에 중간결과가 긍정적이라면 2019년 내 임상 3상을 시작할 것으로 기대된다.
③ 시장 현황
전세계 EB환자수는 50만명으로 추산된다. 피부에서 나타나는 단순 증상 치료에도 연간 3만달러를 초과하고, 대증 치료는 연간 약 6만달러가 소요된다. 2017년 세계 시장 규모는 약 13억달러이다.
( 5 ) OKN-007 : 교모세포종 (Glioblastoma Multiform) 치료제
교모세포종은 뇌종양 중에서도 가장 악성인 질환이다. 재발하는 환자가 많으며 이들의 평균 생존기간은 3~4개월 수준이다.
OKN-007은 미국의 비영리 생명의학 연구재단인 OMRF(Oklahoma Medical Research Foundation)으로부터 License-In하여 Oblato(지트리비앤티의 100% 자회사)가 뇌질환치료제 개발에 대한 글로벌 권리를 획득했다
① 개발 현황
ⓐ 2차 치료제(Secondary Therapy) 임상 : 임상 1b를 완료한 상태이며, 치료제의 안전성(DLT)과 유효성(PFS, OS)은 확인했으나 소수의 환자로 진행된 임상이었기 때문에 통계적 분석까지 진행하진 않았다.
ⓑ 1차 치료제(Primary Therapy)로서의 병용임상 : 오클라호마 대학에서 Temodar과 OKN-007 병용투여 전임상을 진행했다. 교모세포종 오리지널 치료제인 Merk의 Temodar과 OKN-007의 병용요법이 Temodar 단독투여보다 유의미한 효과가 있음을 확인했고, 이를 근거로 재발이전 환자에게 Temodar과 OKN-007의 병용투여 임상이 FDA에서 허가됐다. 즉 표준치료 단계부터 사용되는 약으로도 개발이 진행 중인 것이다.
현재 환자 3명에게 투여 중이며, 총 9명 대상으로 임상을 진행할 예정이다. Open study이기 때문에 중간에 결과를 알 수 있으며, 결과가 유의미할 경우 기술 이전 가능성도 높다.
② 시장 현황
교모세포종은 치료받을 경우 평균 12~15개월, 치료받지 않을 경우 4~5개월의 생존율을 보이고 있다.
미국의 교모세포종 환자수는 약 2만명으로 추산되며 매년 1.2만명의 새로운 환자가 발생하고 있다.
( 6 ) 와이에스팜 흡수합병
2018년 9/14일을 기준일로 공공기관 대상 백신 공급업체인 와이에스팜을 흡수합병햤다. 정부의 독감백신 무료접종 지원사업 대상자 확대로 실적 호전 기대된다

( 7 ) 실적 추이

